A fin de reducir el riesgo de muerte de los pacientes con síndrome de progeria de Hutchinson-Gilford, la FDA ha aprobado las cápsulas de Zokinvy. También se aprueba para el tratamiento de ciertas laminopatías progeroides de procesamiento deficiente. Ello, en pacientes de un año de edad o pacientes mayores. El medicamento no está aún aprobado para su uso en pacientes con otros síndromes progeroides o laminopatías.
¿Qué es el síndrome de progeria?

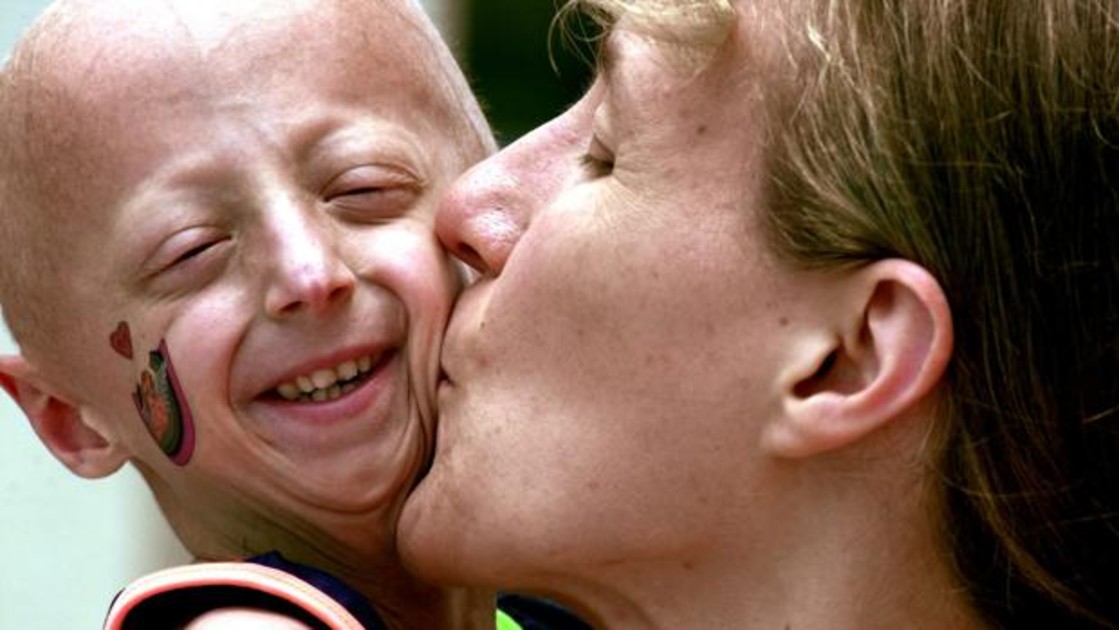
El síndrome de progeria, como así también las laminopatías progeroides son enfermedades genéticas raras. Lo que estas causan es un envejecimiento prematuro y posterior muerte. Tienen un efecto debilitante en la vida de las personas que lo padecen. Al aprobarse este medicamento, se convierte en el primer tratamiento aprobado por la FDA para estas raras enfermedades. No obstante, FDA anuncia que continuará trabajando con las partes interesadas para avanzar en el desarrollo de nuevas terapias que funcionen y que sean seguras y efectivas para estos pacientes.
Las personas que tienen síndrome de progeria experimentan una enfermedad cardiovascular acelerada. Esto se debe en particular a la acumulación de progerina defectuosa o de proteína similar a la progetina en las células. La mayor parte de estos pacientes suelen morir antes de cumplir los 15 años de edad debido a una insuficiencia cardíaca. También se puede dar el fallecimiento por accidente cerebrovascular o por ataque cardíaco.
Zokinvy para síndrome de progeria
Respecto al surgimiento de este medicamento, explica la FDA que:
“Zokinvy, un inhibidor de la farnesiltransferasa, es un medicamento oral que ayuda a prevenir la acumulación de progerina defectuosa o proteína similar a la progerina. La eficacia de Zokinvy para el tratamiento del síndrome de progeria de Hutchinson-Gilford se demostró en 62 pacientes de dos ensayos de un solo brazo que se compararon con pacientes no tratados de otro estudio de historia natural. En comparación con los pacientes no tratados, la esperanza de vida de los pacientes con síndrome de progeria de Hutchinson-Gilford tratados con Zokinvy aumentó en un promedio de tres meses durante los primeros tres años de tratamiento y en un promedio de 2,5 años durante el tiempo máximo de seguimiento de 11 años”.
 Añade, no obstante, que el tratamiento está contraindicado para la coadministración con inhibidores e inductores potentes o moderados de CYP3A. Algunas personas que fueron tratadas con este medicamento han desarrollado ciertas anomalía en las pruebas de laboratorio. Algunas de estas anomalías incluyeron cambios en los niveles de sodio y potasio en la sangre, aumento de los análisis de sangre en el hígado y reducción del recuento de glóbulos blancos. Por eso, se realizan análisis de sangre de rutina de manera periódica. También se ha observado toxicidad ocular en animales, por lo que se recomiendan exámenes oculares periódicos.
Añade, no obstante, que el tratamiento está contraindicado para la coadministración con inhibidores e inductores potentes o moderados de CYP3A. Algunas personas que fueron tratadas con este medicamento han desarrollado ciertas anomalía en las pruebas de laboratorio. Algunas de estas anomalías incluyeron cambios en los niveles de sodio y potasio en la sangre, aumento de los análisis de sangre en el hígado y reducción del recuento de glóbulos blancos. Por eso, se realizan análisis de sangre de rutina de manera periódica. También se ha observado toxicidad ocular en animales, por lo que se recomiendan exámenes oculares periódicos.
Conclusiones
La FDA ha dado la designación de revisión prioritaria. De esa manera, Zokinvy ha recibido la designación de medicamento huérfano. Esto brinda incentivos para ayudar y alentar el desarrollo de medicamentos destinados a enfermedades raras. Además, el fabricante de este medicamento ha recibido un vale de revisión de prioridad de enfermedad pediátrica rara.








Comment here