Recientemente, la Administración de Alimentos y Medicamentos de Estados Unidos (FDA) ha aprobado el sistema MiniMed 770G. Se trata de un dispositivo híbrido de control de la diabetes de circuito cerrado. Está diseñado fundamentalmente para poder mantener un monitoreo automático de la glucosa, brindando de esa manera una administración de insulina en dosis basal adecuada con poca o con ninguna información desde los usuarios o desde sus cuidadores para su utilización. Está pensando particularmente para personas de 2 a 6 años con diabetes del tipo 1.
 Este sistema es un dispositivo único. Es el primero en ser comercializado legalmente y que puede generar un ajuste de la administración de insulina de manera automática. Para hacerlo, tiene en cuenta los valores de monitoreo continuo de glucosa para estos pacientes.
Este sistema es un dispositivo único. Es el primero en ser comercializado legalmente y que puede generar un ajuste de la administración de insulina de manera automática. Para hacerlo, tiene en cuenta los valores de monitoreo continuo de glucosa para estos pacientes.
Al respecto de esto, Stephen M. Hahn, comisionado de la FDA, advierte que:
«Los avances en la ciencia, la tecnología y la fabricación han ayudado a lograr grandes avances en el tratamiento y el control exitoso de la diabetes tipo 1, una enfermedad crónica potencialmente mortal (…) La FDA se dedica a promover políticas que apoya el desarrollo de nuevas tecnologías basadas en estos avances y mantiene su compromiso de ayudar a garantizar que el desarrollo y la expansión de productos que puedan mejorar la calidad de vida de las personas con esta afección, que puede afectar especialmente a los niños, sea seguro y eficaz».
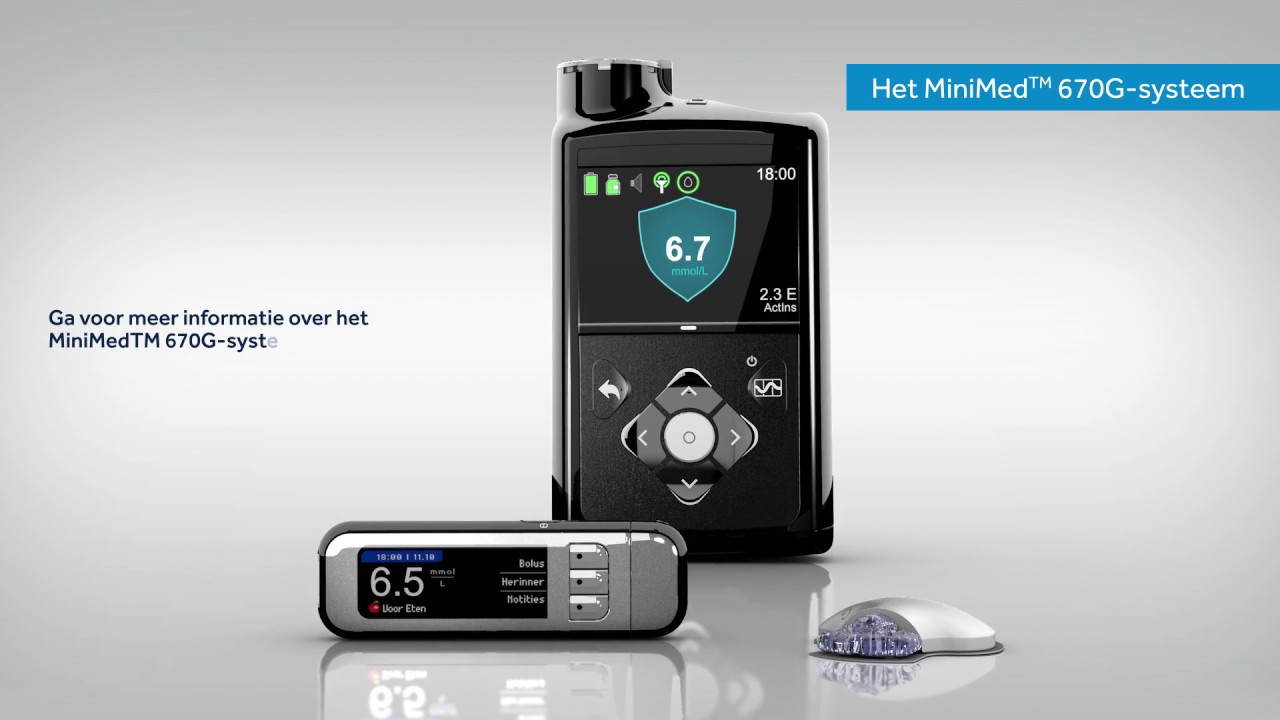
MiniMed 770G para administración de insulina

El sistema MiniMed 770G es una versión habilitada para bluetooth del ya conocido sistema MiniMed 670G. Este ya se encontraba aprobado. El más reciente es un sistema de circuito cerrado híbrido y funciona generando mediciones de los niveles de glucosa en el cuerpo cada cinco minutos. Esto, ajustando de manera automática la administración de insulina. Se puede hacer administrando o ajustando la insulina.
Lo que incluye este sistema es un sensor que se conecta al cuerpo del paciente para poder realizar mediciones de los niveles de glucosa, un parche de infusión conectado a la bomba con un catéter que es el que se encarga de la administración de insulina y una bomba de insulina que se sujeta al cuerpo. Si bien es cierto que el dispositivo se encarga de ajustar los niveles de insulina de manera automática, los usuarios necesitan solicitar de forma manual dosis de insulina para contrarrestar el consumo de carbohidratos al momento de la alimentación.
Estudios de la FDA

Afirma la FDA que:
“(…) evaluó los datos de un ensayo clínico que incluyó a 46 niños de 2 a 6 años con diabetes tipo 1. Los participantes del estudio usaron el dispositivo durante aproximadamente tres meses para evaluar el rendimiento del dispositivo durante los períodos en el hogar y en el hotel, para estresar el sistema con ejercicio diario sostenido. Ese estudio no encontró eventos adversos graves y que el dispositivo es seguro para su uso. Los datos de ese estudio se utilizaron para ayudar a respaldar la indicación ampliada para pacientes de 2 a 6 años.”
Es un dispositivo que no está aprobado para usarse en niños menores de 2 años. A su vez, algunos de los riesgos asociados con su uso pueden incluir: hiperglucemia, hipoglucemia, irritación de la piel y enrojecimiento alrededor del parche.
La FDA finaliza exigiendo que el fabricante del dispositivo lleve a cabo un estudio posterior a la comercialización. Este estudio tendrá por objetivo evaluar el rendimiento del mismo en entornos reales en pacientes de entre 2 y 6 años.








Comment here