Recientemente, la EMA ha recomendado que se conceda una extensión de indicación a Orfadin para la inclusión del tratamiento del trastorno metabólico alcaptonuria en pacientes adultos. Constituye el primer tratamiento para este trastorno poco común.
¿Qué es el trastorno metabólico alcaptonuria?

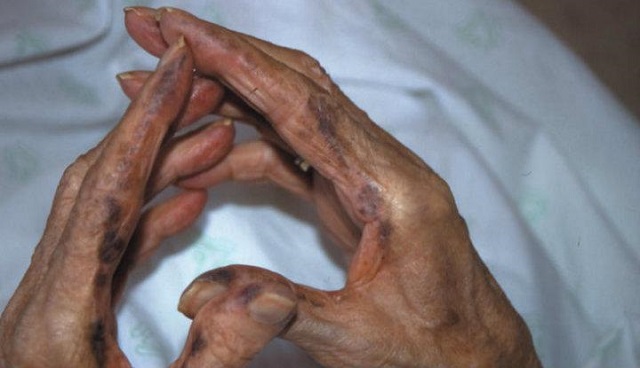
El trastorno metabólico alcaptonuria es un raro trastorno que afecta a una de cada 250.000 personas, siendo más común en diversas zonas de Eslovaquia. Se destaca en particular por generar que el organismo sea incapaz de metabolizar el ácido homogentísico, por la falta de una enzima. Quienes tienen esta enfermedad suelen desarrollar artritis, especialmente en articulaciones grandes y en la columna. Alrededor de la mitad de los pacientes necesitan por lo menos un reemplazo de articulación posteriormente a los 50 años. También pueden tener cálculos renales y ciertos problemas cardíacos.
Hoy en día, no existe todavía un medicamento aprobado para el trastorno metabólico alcaptonuria. Las opciones de tratamiento, en la actualidad, se limitan a tratar los resultados de la enfermedad a medida que estos van apareciendo. Por eso, existe una necesidad médica que se considera insatisfecha para pacientes que tienen este trastorno.
Orfadin en la Unión Europea
El Orfadin está ya aprobado en la Unión Europea, para el tratamiento de la tirosinemia hereditaria tipo 1. Se trata de otra enfermedad rara en la que el cuerpo no logra descomponer el aminoácido tirosina completamente y se forman sustancias que son nocivas y que pueden causar cáncer de hígado y problemas hepáticos graves.
El principio activo del Orfadin es la nitisinona. Lo que hace es reducir la excreción urinaria y los niveles sanguíneos de HGA. Al reducir estos niveles antes de que aparezca una pigmentación azul en el cartílago y el tejido conectivo, lo que hace es prevenir el desarrollo de signos y síntomas debilitantes de la enfermedad. Estos, en general, no se manifiestan hasta la edad adulta temprana.
Indican la EMA que:
“El desarrollo de Orfadin para el tratamiento de la alcaptonuria fue posible gracias al trabajo realizado dentro del programa Desarrollo clínico de nitisinona para la alcaptonuria (DevelopAKUre) por un consorcio de investigación internacional. La Comisión Europea contribuyó a la financiación de DevelopAKUre con una subvención de aproximadamente 6 millones de euros en el contexto del Séptimo Programa Marco (7PM), el programa de financiación de la investigación e innovación de la UE para los años 2007-2013”.
Desarrollo de un nuevo tratamiento

El comité de medicamentos humanos de la EMA basa su opinión en dato de un estudio clínico aleatorizado. Este ha comparado la eficacia y la seguridad del tratamiento con este principio activo con ningún tratamiento a lo largo de un período de cuatro años. Participaron 138 pacientes con alcaptonuria. El objetivo del estudio fue medir la reducción de los nieles de HGA en la orina. Los pacientes participantes lograron una reducción del 99,7% en comparación con quienes no tuvieron un tratamiento con nitisinona. También se registró una reducción considerable de la gravedad de la enfermedad de acuerdo con un conjunto de parámetros acordados internacionalmente.
Para avanzar en el proyecto, finaliza la EMA que:
“El dictamen adoptado por el CHMP en su reunión de septiembre de 2020 es un paso intermedio en el camino de Orfadin hacia el acceso de los pacientes en esta nueva indicación. El dictamen del CHMP se enviará ahora a la Comisión Europea para la adopción de una decisión sobre una autorización de comercialización en toda la UE. Una vez que se ha concedido una autorización de comercialización, las decisiones sobre el precio y el reembolso se tomarán a nivel de cada Estado miembro, teniendo en cuenta la función / uso potencial de este medicamento en el contexto del sistema nacional de salud de ese país”.








Comment here